Die Brennstoffzelle wurde schon 1839 von dem Engländer Sir W. R. Grove entwickelt. Sie ist eine elektrochemische Vorrichtung, die die chemische Energie des Wasserstoffes (oder anderer energiereicher Verbindungen) unmittelbar in Strom (und Wärme) umsetzt. In der Zelle läuft dabei folgender chemischer Prozeß ab:
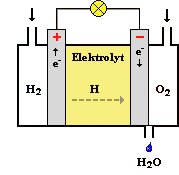 Anode: H2 ==> 2H+ + 2e–
Anode: H2 ==> 2H+ + 2e–
Kathode: 4H+ + O2 + 4e– ==> 2 H2O
An die Anode (den Plus-Pol) wird permanent Wasserstoff (H2) und an die Kathode (den Minus-Pol) Sauerstoff (O2) geleitet. An der Anode spaltet sich unter Abgabe von Elektronen der Wasserstoff in Wasserstoff-Protonen auf. Diese Protonen gelangen durch das elektronenundurchlässige Elektrolyt zur Kathode, wo sie mit dem Sauerstoff zu Wasser reagieren. Die hierfür ebenfalls benötigten Elektronen müssen durch die externe Verbindung fliessen und können somit genutzt werden.
Eine einzelne Brennstoffzelle erzeugt nur weniger als ein Volt Spannung, daher werden für höhere Spannungen mehrere Zellen in sog. »stacks« in Reihe geschaltet. Im Vergleich zur konventionellen Energiegewinnung liegt der elektrische Wirkungsgrad einer Brennstoffzelle mit rund 60 – 70 Prozent [Herstellerangabe Sulzer Hexis] wesentlich höher (je nach Zelltyp lohnt sich auch die Nutzung der Reaktionswärme). Die meisten Zellen können mit dem Luft-Sauerstoff arbeiten, so daß kein separater Sauerstoffspeicher nötig ist.

